Chỉ tiêu DO
DO là lượng oxy hòa tan trong nước cần thiết cho sự hô hấp của các sinh vật trong nước (cá, lưỡng thể, thùy sinh, côn trùng,…) thường được tạo ra do sự hòa tan từ khí quyển hoặc do quang hợp của tảo. Nồng độ oxy tự do trong nước khoảng 8-10 ppm, và dao động phụ thuộc vào nhiệt độ, sự phân hủy hóa chất, sự quang hợp của tảo, dòng chảy, địa hình,… Các sông hồ có hàm lượng DO cao được coi là khỏe mạnh và có nhiều loài sinh vật sống trong đó. Khi DO giảm thấp sẽ làm giảm khả năng sinh trưởng của động vật thủy sinh, thậm chí có thể làm biến mất hoặc gây chết một số loài nếu DO giảm đột ngột.
Nguyên nhân làm giảm DO trong nước có thể do việc xả nước thải công nghiệp, nước mưa chảy tràn lôi kéo các chất thải nông nghiệp chứa nhiều chất hữu cơ, vi sinh vật sử dụng oxy để tiêu thụ các chất hữu cơ làm cho lượng oxy giảm.
Do vậy, DO là một chỉ số quan trọng để đánh giá sự ô nhiễm nước của các thủy vực. Phân tích DO có thể hỗ trợ ta đánh giá mức độ ô nhiễm nguồn nước và kiểm tra quá trình xử lý nước thải.
Có thể xác định DO bằng 2 cách
- Phương pháp điện cực hòa tan oxy (dùng máy đo)
- Phương pháp Winkler
Phương pháp Wikler được tiến hành như sau: Oxy trong nước được cố định ngay sau khi lấy mẫu bằng hỗn hợp chất cố định (MnSO4, KI, NaN3), lúc này oxy hòa tan trong mẫu sẽ phản ứng với Mn2+ thành MnO2. Khi đem về PTN, thêm axit sulfuric hoặc phosphoric vào mẫu, lúc này MnO2 sẽ oxy hóa I- thành I2. Chuẩn độ I2 tạo thành bằng Na2S2O3 với chỉ thị hồ tinh bột.Tính ra lượng O2 có trong mẫu theo công thức:
DO (mg/l) = (VTB x N / VM) x 8 x 1.000
Trong đó, 8 là đương lượng gam của oxy, 1.000 là hệ số chuyển đổi thành lít, VM là thể thích (ml) mẫu nước đem đi chuẩn độ, VTB là thể tích trung bình dung dịch Na2S2O3 0,01N (ml) trong các lần chuẩn độ.
Chỉ tiêu BOD
Nhu cầu oxy sinh hóa (Biochemical Oxygen Demand-BOD) là lượng oxy cần thiết để vi sinh vật oxy hóa các chất hữu cơ có khả năng phân hủy sinh học trong điều kiện hiếu khí.
Khi xảy ra quá trình oxy hóa học, các vi khuẩn sử dụng oxy hòa tan trong nước. Vì vậy xác định hàm lượng oxy hòa tan trong nước là rất cần thiết, nó là một chỉ tiêu đánh giá ảnh hưởng các chất hữu cơ đến nguồn nước trong quá trình oxy hóa sinh học. BOD5 chính là lượng oxy cần thiết để vi sinh vật oxy hóa hết hợp chất hữu cơ trong nước gây ra, với thời gian xử lý nước là 5 ngày đầu ở nhiệt độ 20ºC trong buồng tối để tránh ảnh hưởng các quá trình quang hợp. BOD được sử dụng rộng rãi trong kỹ thuật môi trường. BOD là chỉ tiêu quan trọng để xác định mức độ ô nhiễm của nước thải công nghiệp và nước thải sinh hoạt qua chỉ số oxy hóa dùng để khoáng hóa hợp chất hữu cơ dễ phân hủy sinh học.
BOD là chỉ tiêu duy nhất để xác định chất hữu cơ có khả năng phân hủy sinh học tồn tại trong nước, xác định tốc độ oxy hóa xảy ra trong nguồn nước. Ngoài ra có thể dùng để đánh giá khả năng tự làm sạch của nguồn tiếp nhận. BOD còn được ứng dụng để ước lượng công thức các công trình xử lý sinh học, cũng như đánh giá hiệu quả của các công trình xử lý. Còn là một trong những chỉ tiêu quan trọng nhất để kiểm soát ô nhiễm môi dòng chảy.
Phương pháp xác định BOD được thực hiện bằng cách hòa loãng mẫu thử, thêm một lượng cố định vi sinh vật, đo DO rồi đậy kín nắp và mang đi bảo quản tối ở nhiệt độ 20oC trong vài ngày. Sau đó ta mang ra đo lại DO, độ chênh lệch lượng DO cuối là lượng ban đầu chính là BOD. Như vậy ta có công thức:
BODx = DO0 – DOx
Trong đó x là số ngày bảo quản tối ở 20oC, thường là 5 ngày.
Tuy nhiên ngày nay, việc đo BOD được thực hiện bằng chai đo BOD Oxitop. Đặt chai trong tủ với nhiệt độ 20oC trong 5 ngày, BOD sẽ được đo tự động khi nhiệt độ đạt tới 20oC, giá trị BOD sẽ được ghi tự động sau mỗi 24h.
Chỉ tiêu COD
COD (Chemical Oxygen Demand – nhu cầu oxy hóa học) là lượng oxy cần thiết để oxy hoá các hợp chất hoá học trong nước bao gồm cả vô cơ và hữu cơ. COD là lượng oxy cần để oxy hoá toàn bộ các chất hoá học trong nước.
Các thông số COD cho thấy số lượng các hợp chất hữu cơ trong nước có thể bị oxy hóa hóa học.Đánh giá một cách đầy đủ lượng oxy cần thiết để oxy hóa tất cả các chất hữu cơ trong nước thải người ta sử dụng chỉ tiêu nhu cầu oxy hóa học. Để xác định chỉ tiêu này, người ta thường dùng potassium dichromate (K2Cr2O7) để oxy hóa hoàn toàn các chất hữu cơ, sau đó dùng phương pháp phân tích định lượng và công thức để xác định hàm lượng COD.
Hàm lượng COD trong nước cao thì chứng tỏ nguồn nước có nhiều chất hữu cơ gây ô nhiễm. COD có thể cho biết hàm lượng chất hữu cơ có trong nước nên đây là tiêu chuẩn quan trọng để đánh giá mức độ ô nhiễm của nước (nước thải, nước mặt, nước sinh hoạt).
Phương pháp xác định COD được tiến hành bằng cách pha loãng mẫu thử theo 1 nồng độ thích hợp, cho thêm K2Cr2O7 vào, cho từ từ H2SO4 regant theo tỉ lệ nhất định rồi đậy kín nắp. Mang mẫu thử đi đun ở nhiệt độ 150oC trong 2 giờ, để nguội về nhiệt độ phòng rồi cho ra bình tam giác 100ml rồi định phân lượng K2Cr2O7 thừa bằng FAS 0,1M với 1-2 giọt chỉ thị ferroin cho đến khi mẫu chuyển từ màu xanh lá sang màu nâu đỏ. COD sẽ được tính bằng công thức:
COD (mgO2/L) = ( (A – B) x M x 8000 ) / ml mẫu
Tỉ lệ thể tích mẫu và hóa chất dùng trong phân tích COD như sau:
| Ống nghiệm
(d x l) |
Thể tích mẫu
(ml) |
Dung dịch
K2Cr2O7 |
H2SO4
regant |
Tổng thể tích
(ml) |
| 20 x 150mm
25 x 150mm Ống chuẩn 10ml |
5,0
10,0 2,5 |
3,0
6,0 1,5 |
7,0
14,0 3,5 |
15,0
30,0 7,5 |
Tỉ lệ giữa BOD và COD
Thông số BOD đặc trưng cho phần chất hữu cơ dễ bị vi khuẩn phân hủy, đối với các chất hữu cơ khóa bị phân hủy như hóa phẩm hữu cơ, sau thời gian ủ ngắn ngày (5 ngày) có thể bỏ qua sự phân hủy của chúng. Sau 5 ngày ủ, trong điều kiện thuận lợi nhất, vi khuẩn cũng chĩ phân hủy được 60-70% chất hữu cơ có nguồn gốc sinh vật, vì vậy BOD5 không biểu thị tổng hàm lượng chất hữu cơ dễ bị phân hủy sinh học mà cỏi là một thông số đặc trưng cho hàm lượng chất hữu cơ này.
Thông số COD là lượng oxy cần thiết để oxy hóa hoàn toàn chất hữu cơ có trong nước, (cả nguồ gốc sinh vật lẫn phi sinh vật), vì vậy thông số COD luôn luôn lớn hơn thông số BOD. Và từ đó ta có tỉ lệ BOD/COD luôn luôn bé hơn 1, thông thường khoảng xấp xỉ từ 0,5 – 0,7.
Nếu nước thải có tỉ lệ BOD/COD càng nhỏ, thì nước thải có phần chất hữu cơ dễ phân hủy sinh học chiếm tỉ phần càng ít. Đối với loại nước này, xử lý sinh học sẽ kém hiệu quả. Nếu trong nước có chất độc, tiêu diệt hoặc ức chế hoạt động của vi khuẩn thì thông số BOD có thể rất thấp, thậm chí có thể bằng 0, nhưng thông số COD trong nước thải này vẫn cao (ví dụ nước thải bệnh viện), nếu xử lý sinh hoạc ngay thì hiệu quả sẽ kém. Vì vậy cần phải có biện pháp xử lý thích hợp để làm giảm độc tố đối với vi khuẩn trước rồi mới tiến hành xử lý sinh học. Như vậy, tỉ lệ BOD/COD là cơ sở để lựa chọn biện pháp xử lý nước thải cho phù hợp và hiệu quả.
Tỉ lệ giữa BOD và COD đối với các mẫu nước thải khác nhau sẽ có giá trị khác nhau. Trị số BOD và COD trung bình trong nước thải một số ngành công nghiệp như sau:
| Ngành công nghiệp | BOD
(mgO2/L) |
COD
(mgO2/L) |
BOD/COD |
| Hóa chất | 580 | 1.500 | 0,38 |
| Thực phẩm | 2.242 | 3.970 | 0,56 |
| Dệt | 592 | 1.303 | 0,45 |
| Giấy | 588 | 991 | 0,59 |
| Bột giặt | 2.650 | 5.790 | 0,46 |
| Hóa dầu | 1.750 | 3.844 | 0,45 |
|
Cao su |
119 | 308 | 0,65 |
(Nguồn: Hóa học nước tự nhiên, Trần Ngọc Lan)
Sự tồn tại của chất hữu cơ có nguồn gốc sinh vật và phi sinh vật trong nước phụ thuộc vào đạc tính của nước thải. Hai thành phần này tồn tại trong nước không theo một hệ định lượng nào, vì vậy về nguyên tắc không thể suy từ thông số BOD sang COD và ngược lại.
Thông tư số 04 hướng dẫn thi hành nghị định về xử lý nước thải
Chỉ tiêu chất rắn lơ lửng
Chất rắn tổng TS
Tổng các chất rắn trong nước thải là phần còn lại sau khi đã cho nước thải bay hơi hoàn toàn ở nhiệt độ 1050C. Các chất bay hơi ở nhiệt độ này không được coi là chất rắn. tổng chất rắn được biểu thị bằng đơn vị mg/l.
TS được xác định bằng phương pháp bốc hơi và làm khô mẫu, lấy 10ml mẫu nước thải đem sấy ở nhiệt độ 1050C cho đến khi trọng lượng không đổi. Sau khi đã sấy xong, mang mẫu để vào bình hút ẩm cho tới nhiệt độ phòng, rồi đem đi cân mẫu.
TS có ảnh hưởng xấu đến chất lượng nước hoặc nước thải, nguồn nước có hàm lượng TS cao thường có vị, có khả năng gây các phản ứng hóa lí gây ảnh hưởng nghiêm trọng trong quá trình xử lí nước thải bằng phương pháp sinh học.
Tổng chất lơ lửng SS
Chất rắn lơ lửng là các hạt nhỏ (hữu cơ hoặc vô cơ) trong nước thải. Khi vận tốc của dòng chảy bị giảm xuống ( do nó chạy vào hồ chứa lớn) phần lớn các chất rắn lơ lửng sẽ lắng xuống đáy hồ, những hạt không lắng sẽ tạo thành độ đục của nước. Các chất lơ lửng hữu cơ sẽ tiêu thụ oxy để phân hủy làm giảm DO trong nước. Các cặn lắng sẽ làm đầy các bể chứa làm giảm thể tích hữu dụng của các bể này, đơn vị mg/l.
VSS được xác định bằng cách, nung giấy lọc thủy tinh ở nhiệt độ 1050C đến khi khối lượng không đổi, sau đó để giấy lọc trong bình hút ẩm, rồi đem đi cân để xác định khối lượng ban đầu, gấp miếng giấy lọc thành hình cái phễu để trên miệng bình chứa, hút 10ml mẫu nước thải cho từ từ vào phễu, chờ cho nước trong giấy lọc chảy xuống hết bình chứa, sau đó đem miếng giấy lọc vào tủ sấy và sấy ở 1050C, sau khi sấy đến khối lượng không đổi, lấy giấy lọc ra và để vào bình hút ẩm cho tới nhiệt độ phòng, rồi đem đi cân lại mẫu giấy được khối lượng, tiếp tục sấy mẫu ở nhiệt độ 5500C cho đến khối lượng không đổi, đưa mẫu vào bình hút ẩm, cân mẫu để xác định lượng chất rắn lơ lửng bay hơi mất đi.
Hàm lượng chất rắn lơ lửng phụ thuộc chủ yếu vào lượng nước sử dụng, lượng nước tiêu thụ càng lớn thì hàm lượng các chất rắn lơ lửng càng nhỏ và ngược lại. Tùy theo kích thước hạt, trọng lượng riêng, tốc độ dòng chảy và các tác nhân hóa học mà các chất lơ lửng có thể lắng xuống đáy, nổi lên mặt nước hay ở trạng thái lơ lửng. Các chất rắn lơ lửng có thể làm tăng khả năng bùn lắng và tạo điều kiện môi trường kị khí khi nước thải chưa xử lí được thải vào môi trường.
Các quy chuẩn của Bộ Tài Nguyên Môi Trường về xử lý nước thải
Tổng chất rắn bay hơi VS
Là trọng lượng bị mất đi khi sấy ở nhiệt độ 5500C, đơn vị là mg/l.
Xác định TVS bằng phương pháp bốc hơi và làm khô mẫu, lấy 10ml mẫu nước thải đem vào tủ sấy ở nhiệt độ 5500C đến khối lượng không đổi, khi đã sấy xong mang mẫu để vào bình hút ẩm cho tới nhiệt độ phòng, rồi đem đi cân mẫu, phần bay hơi là các chất hữu cơ bay hơi VSS, phần còn lại sau khi sấy là các chất vô cơ FSS.
TVS là chỉ tiêu để đánh giá nồng độ nước thải, xác định lượng chất rắn lơ lửng còn lại sau khi qua xử lí.
5.4. Tổng chất rắn hòa tan DS
Chất rắn hòa tan là các chất hòa tan không lọc được bao gồm các hạt keo và chất hòa tan. Các keo có kích thước từ 0,001 – 1 mm, các hạt keo này không thể loại bỏ bằng phương pháp lắng cơ học. Các chất hòa tan có thể là phân tử hoặc ion của chất hữu cơ hay vô cơ, hầu hết các chất ở dạng hòa tan là các muối vô cơ và lượng nhỏ các chất hữu cơ và khí hòa tan. Tổng hàm lượng chất rắn hòa tan của nước cấp cho sinh hoạt thường nằm trong khoảng 20- 1000mg/l và theo quy luật, độ cứng tăng theo hàm lượng tổng chất rắn hòa tan, đơn vị tính là mg/l.
TDS được xác định bằng cách, lấy 10ml mẫu lọc qua giấy lọc, đem lượng nước thải đã qua lọc bỏ vào tủ sấy ở nhiệt độ 1800C cho đến khối lượng không đổi, bỏ vào bình hút ẩm và cân xác định khối lượng. TDS được xác định bằng công thức:TDS= TS-TSS.
Trong việc nghiên cứu chất lượng nước của các con suối, sông, hồ, mặc dù TDS thường không được coi là một chất gây ô nhiễm chính, nhưng TDS được sử dụng như một chỉ số về đặc tính chất lượng của nước uống và là một chỉ số tổng hợp của sự hiện diện của một loạt các chất gây ô nhiễm hóa học.
Chất rắn có khả năng lắng
Là thành phần chất rắn trong nước tồn tại ở dạng lơ lửng nhưng có thể lắng trong trạng thái tĩnh do ảnh hưởng của trọng lực, những hạt chất rắn có kích thước lớn và khối lượng riêng đủ lớn so với khối lượng riêng của nước sẽ lắng trong một khoảng thời gian nhất định. Lượng chất rắn lơ lửng lắng được biểu thị bằng đơn vị mg/l.
Xác định chất rắn có khả năng lắng dùng dụng cụ thủy tinh gọi là nón Imhoff có chia vạch thể tích. Cho 1 lít nước thải vào nón Imhoff để cho lắng tự nhiên trong vòng 45 phút, sau đó khuấy nhẹ sát thành nón rồi để lắng tiếp trong vòng 15 phút. Sau đó đọc thể tích chất lơ lửng lắng được bằng các vạch chia bên ngoài.
Để xác định chất rắn nào sẽ lắng được bằng trọng lực trong một khoảng thời gian nhất định. Chỉ tiêu chất rắn có khả năng lắng biểu diễn gần đúng lượng bùn có thể loại bỏ được bằng bể lắng sơ cấp. Việc xác định này có ý nghĩa quan trọng trong thực tế để tính toán công trình lắng trong hệ thống xử lí nước thải và đánh giá đặc tính lí học của dòng thải khi xả vào nguồn tiếp nhận.
MLSS (Mixed Liquor Suspended Solid)
MLSS hay chất rắn lơ lửng trong bùn lỏng là hỗn hợp được hòa trộn từ bùn hoạt tính và nước thải. Đây chính là hàm lượng bùn cặn (bao gồm cả sinh khối vi sinh vật và các loại chất rắn có trong bùn). MLSS phụ thuộc vào lưu lượng tuần hoàn của bùn hoạt tính và cần duy trì trong khoảng 2500-3500mg/l.
Xác định MLSS bằng cách đem sấy mẫu giấy lọc ở nhiệt độ 1050C cho đến khối lượng không đổi,bỏ mẫu giấy vào bình hút ẩm, lấy 100ml nước thải trong bể hiếu khí rồi lọc qua giấy lọc để thu bùn có trong nước thải, lấy giấy sau khi lọc, sấy khô ở nhiệt độ
1050C cho đến khối lượng không đổi, sau đó đem mẫu giấy đã sấy bỏ vào bình hút ẩm, đem đi cân sẽ được hàm lượng bùn hoạt tính lơ lửng MLSS, đơn vị là mg/l.
Thông số MLSS và MLVSS đóng vai trò quan trọng trong phân tích bùn thô và bùn đã phân hủy, thường được áp dụng đánh giá chất lượng bùn.
MLVSS (Mixed Liquor Volatile Suspended Solid)
MLSS hay chất rắn lơ lửng trong bùn lỏng là hỗn hợp được hòa trộn từ bùn hoạt tính
và nước thải. Đây chính là hàm lượng bùn cặn (bao gồm cả sinh khối vi sinh vật và các
loại chất rắn có trong bùn). MLSS phụ thuộc vào lưu lượng tuần hoàn của bùn hoạt tính
và cần duy trì trong khoảng 2500-3500mg/l.
Xác định MLVSS là lấy MLSS đem đi nung ở nhiệt độ 5500C, lấy khối lượng ban đầu trừ đi khối lượng cặn, còn lại thì gọi là MLVSS. Cặn không bay hơi còn lại gọi là cặn tro hay cặn vô cơ. MLVSS bằng 70% MLSS nếu chất lượng bùn hoạt tính tốt.
MLVSS trong bể hiếu khí là chỉ số nói lên chất lượng bùn vi sinh đóng vai trò quan trọng trong việc kiểm soát nồng độ bùn trong hệ thống hiếu khí.
Bảng nồng độ các chất ô nhiễm trong nước thải sinh hoạt chưa qua xử lí:
|
Các chỉ tiêu |
Nồng độ | |||
|
Nhẹ |
Trung bình |
Nặng |
||
| Chất rắn tổng cộng |
350 |
720 |
1200 |
|
| Tổng chất rắn hòa tan |
250 |
500 |
850 |
|
| Cố định |
145 |
300 |
525 |
|
| Bay hơi |
105 |
200 |
325 |
|
| Chất rắn lơ lửng |
100 |
220 |
350 |
|
| Cố định |
20 |
55 |
75 |
|
| Bay hơi |
80 |
165 |
275 |
|
| Chất rắn lắng được |
5 |
10 |
20 |
|
Bảng các chỉ tiêu thông dụng đặc trưng cho các tính chất lí học, hóa học và sinh học của nước thải đô thị:
| Các chỉ tiêu đặc trưng | Kí hiệu/
định nghĩa |
Ý nghĩa |
| Các chỉ tiêu lí học | ||
| Chất rắn tổng cộng | TS |
Để đánh giá khả năng tái sử dụng nước thải và để xem dạng công trình và quá trình nào là thích hợp nhất để xử lí chung. |
| Tổng chất rắn dễ bay hơi | TVS | |
| Chất rắn lơ lửng | SS | |
| Chất rắn lơ lửng dễ bay hơi | VSS | |
| Tổng chất rắn hòa tan = TS-SS | TDS | |
|
Chất rắn có thể lắng được |
Để xác định xem các chất rắn nào sẽ lắng được bằng trọng lực trong một khoảng thời gian nhất định. | |
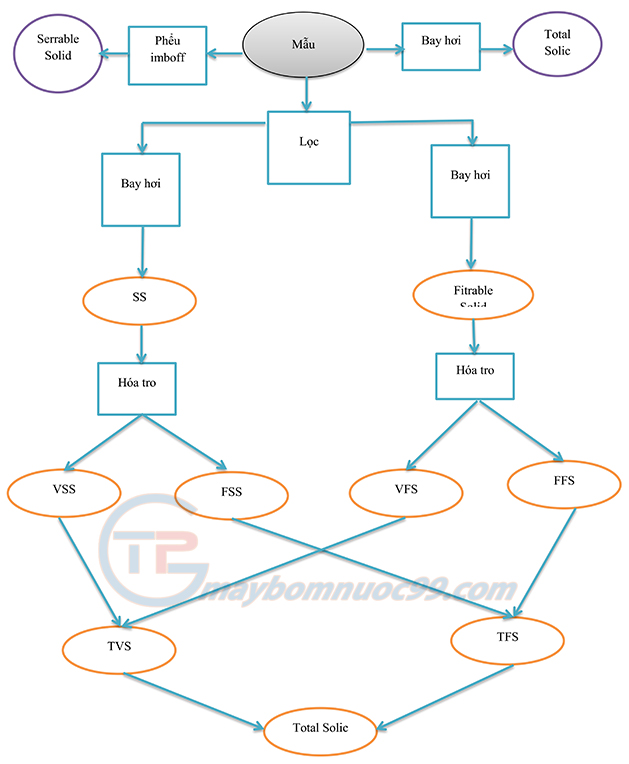
Để dễ xác dịnh các chi tiêu hơn, ta có thể tham khảo sơ đồ sau:
Chỉ tiêu Coliform
Vi khuẩn Coliforms là một loại vi khuẩn gram kỵ khí, có dạng hình que và không bào tử. Vi khuẩn Coliform thuộc nhóm vi khuẩn phổ biến và tồn tại được trong nhiều môi trường khác nhau như đất, nước (nước uống, nước sinh hoạt và nước nuôi trồng thủy sản), thực phẩm và trong phân động vật. Vi khuẩn phổ biến trong nhóm Coliform là Escherichia Coli (E.coli), đây là một loại vi khuẩn thường ký sinh có trong hệ tiêu hóa của người. Nếu phát hiện vi khuẩn E.Coli thì có nghĩa là nguồn nước đã có dấu hiệu ô nhiễm phân.
E.coli và Coliform trong nước có thể định lượng bằng phương pháp màng lọc theo TCVN 6187-1:2009, phương pháp này dựa vào việc lọc một lượng mẫu nước đã biết qua màng lọc có đường kính lỗ thích hợp có khả năng giữ lại vi khuẩn. Màng sau khi lọc được đặt trên môi trường Lactose TTC và ủ ở nhiệt độ 36℃ trong 24 giờ (phép thử tiêu chuẩn). Hoặc màng sau khi lọc mang đặt trên môi trường Triptophan và ủ ở 36℃ trong 4-5h, sau đó ủ ở 44℃ khoảng 20h trên môi trường Triptophan với muối mật. Coliform là những vi khuẩn có khả năng hình thành khuẩn lạc hiếu khí trên môi trường Lactose TTC với 360C,
còn E.coli là vi khuẩn Coliform mà chúng có khả năng sinh indol từ môi trường Tryptophan với 440C.
Đối với phép thử tiêu chuẩn, những khuẩn lạc đặc trưng trên màng được đếm là vi khuẩn dương tính với lactoza. Đối với vi khuẩn coliform và e.coli việc cấy thử được tiến hành từ những khuẩn lạc đặc trưng đã được chọn ngẫu nhiên để khẳng định loại sinh ra oxydaza và indol, ta đếm số coliform dương tính với lactoza và e.coli có trong 100 ml mẫu.
Đối với phép thử nhanh, những khuẩn lạc trên màng có khả năng tạo indol từ tryptophan trong môi trường thạch được đếm là e.coli, ta đếm số e.coli có trong 100 ml mẫu.
Theo quy chuẩn kỹ thuật quốc gia về chất lượng nước, hàm lượng E.coli và Coliform được quy định như sau:
- Trong nước ăn uống (QCVN 01:2009/BYT): hàm lượng E.coli và Coliform tổng số bằng 0 vi khuẩn /100ml.
- Trong nước sinh hoạt (QCVN 02:2009/BYT): hàm lượng E.coli là 0 vi khuẩn/100ml và Coliform tổng số trong nước sạch được cho phép 50 vi khuẩn/100 ml.
- Trong nước thải công nghiệp (QCVN 40:2011/BTNMT): hàm lượng Coliform là 3000 mg/l đối với nước thải loại A và 5000 mg/l đối với nước thải loại B.
Số liệu Coliform cung cấp cho chúng ta thông tin về mức độ vệ sinh của nước và điều kiện vệ sinh cùa môi trường xung quanh. Nếu E.coli xuất hiện trong nước có nghĩa là có sự ô nhiễm và các mầm bệnh khác có thể có mặt. Nếu E.coli không có nhưng tổng Coliform lớn hơn 0 thì có thể:
- Xuất hiện một lớp vi khuẩn phát triển trong hệ thống ống nước, lớp vi khuẩn này được gọi là màng sinh học.
- Nguồn nước mặt có thể đã tràn vào giếng, điều này làm tăng nguy cơ kéo theo chất thải động vật gây ô nhiễm nước.
- Nước giếng có thể đến từ các tầng nước có chứa vi khuẩn, thường gặp với giếng nông như giếng đào hay giếng khoan nhưng không sâu.
Vào thời gian đầu đa số người bị nhiễm khuẩn coliform trong nước sẽ không có dấu hiệu hay các triệu chứng mắc bệnh. Sau đó khoảng 3-4 ngày là thời gian ủ bệnh của loại vi khuẩn này sẽ gây ra hàng loạt các triệu chứng ảnh hưởng đến đường ruột. Các triệu chứng phổ biến nhất là những cơn đau bụng âm ĩ, có thể là tiêu chảy nhẹ, sốt nhẹ hoặc tiêu chảy ngắt quãng không kèm theo sốt. Tùy từng trường hợp và tùy từng đối tượng mà biểu hiện bệnh khác nhau nhưng đa số người nhiễm khuẩn coliform trong nước thường tự hồi phục, điều trị chủ yếu bằng bù nước và điện giải. Tuy nhiên, trong một vài trường hợp đặc biệt nhất là ở trẻ em và người cao tuổi thì bệnh tình có khả năng chuyển biến xấu và nghiêm trọng hơn. Có khả năng phát triển hội chứng tăng urê máu có tán huyết gây suy thận, xuất huyết và các vấn đề thần kinh khác. Những trường hợp này thường có tỷ lệ tử vong vào khoảng 3-5% . Vì vậy, việc kiểm tra chỉ tiêu Coliform trong nước nói chung là vô cùng cần thiết.
Chỉ tiêu dầu mỡ
Dầu và mỡ (oil and grease) là chất hữu cơ được chiết từ nước hoặc nước thải. Sự có mặt của dầu mỡ trong nước thải sinh hoạt và nước thải công nghiệp là mối quan tâm của xã hội vì sự ảnh hưởng của chúng đến sinh vật thủy sinh. Nếu chúng không được xử lý sẽ ảnh hưởng rất nghiêm trọng đến nguồn tiếp nhận: chết cá, sinh vật dưới nước sẽ thiếu oxy và chết,…Vì thế trước khi xả ra nguồn tiếp nhận, nhà nước yêu cầu tất cả các nhà máy, cơ sở chế biến phải xử lý nước thải tại nguồn đạt tiêu chuẩn cho phép trước khi xả ra nguồn tiếp nhận.
Các quy định và tiêu chuẩn đã được thiết lập để giám sát dầu và mỡ có trong nước và nước thải, trong đó có:
- TCVN 7875:2008 Nước – Xác định dầu mỡ – Phương pháp chiếu hồng ngoại
- TCVN 9718:2013 Chất lượng nước – Phương pháp xác định hàm lượng dầu, mỡ, và hydrocacbon dầu mỏ trong nước
Dầu mỡ có thể được xác định bằng 2 phương pháp:
- Xác định bằng phương pháp chiếu hồng ngoại (TCVN 7875:2008)
Sử dụng triclrotrifloroetan làm dung môi chiết để hấp thụ liên kết cacbon-hydro có trong dầu và mỡ, dùng phương pháp hấp thụ hồng ngoại để định lượng. Việc bỏ qua quy trình bay hơi cho phép phát hiện bằng hồng ngoại tương đối nhiều hydrocacbon dễ bay hơi. Do vậy, các sản phẩm chưng cất dầu mỏ nhẹ hơn, không bao gồm xăng, có thể được đo một cách chính xác. Bằng thiết bị thích hợp có thể xác định được lượng dầu và mỡ đến 0,2 mg/l.
Nồng độ của dầu và mỡ, ký hiệu C (mg/l), tính theo công thức:
C = (A x 1000) / V
Trong đó, A là khối lượng dầu hoặc mỡ trong phần chiết được xác định từ đường chuẩn, tính bằng mg, V là thể tích mẫu, tính bằng ml.
- Xác định dầu mỡ trong nước (TCVN 9718:2013)
Sử dụng triclrotrifloroetan làm dung môi chiết để hấp thụ liên kết cacbon-hydro có trong dầu và mỡ, dùng phương pháp hấp thụ hồng ngoại để định lượng. Việc bỏ qua quy trình bay hơi cho phép phát hiện bằng hồng ngoại tương đối nhiều hydrocacbon dễ bay hơi. Do vậy, các sản phẩm chưng cất dầu mỏ nhẹ hơn, không bao gồm xăng, có thể được đo một cách chính xác. Bằng thiết bị thích hợp có thể xác định được lượng dầu và mỡ đến 0,2 mg/l.
Tính nồng độ dầu và mỡ trong nước hoặc nước thải ban đầu, làm tròn tới 0,1 mg/L như sau:
Dầu và mỡ (mg/l) = (R x D) / V
Trong đó, R (mg) là lượng dầu và mỡ trong 100 ml dịch chiết chưa được xử lý, đã tính ở muc 12.1 của TCVN 9718:2013, V (l) là thể tích của nước chiết đã tính ở mục 11.1.6 của tiêu chuẩn, D là hệ số pha loãng, nếu có, như đã sử dụng trong mục 11.2 của tiêu chuẩn, với D được tính bằng công thức:
D = thể tích dịch chiết pha loãng / thể tích dịch chiết chưa pha loãng
Dầu mỡ là thành phần chủ yếu có trong nước thải sinh hoạt, đặc biệt là nước thải nhà hàng có lượng dầu mỡ trong nước thải rất cao, nếu không có biện pháp xử lý nhằm loại bỏ lượng dầu mỡ này trong nước thải sẽ gây tắc nghẽn đường ống, hư bơm, phát sinh mùi hôi và làm chết vi sinh.
Chỉ tiêu Nitơ trong nước thải
Nitơ là một trong những nguyên tố có vai trò quan trọng trong sự hình thành sự sống trái đất. Là thành phần quan trọng tạo nên protein cũng như trong các axit amin trong nhân của tế bào. Hầu hết, các sinh vật và các bã thải trong quá trình sống của chúng đều có chứa những hàm lượng Nitơ nhất định. Và bị vi sinh vật dị dưỡng phân hủy trở thành các hợp chất vô cơ như amoni. Như vậy, trong môi trường nước luôn tồn tại các thành phần chứa nitơ, từ các protein. Chúng có cấu trúc phức tạp đến từ các axit amin đơn giản.
Các hợp chất nitơ là các chất dinh dưỡng, chúng luôn vận động trong tự nhiên, chủ yếu nhờ các quá trình sinh hoá. Hợp chất hữu cơ chứa nitơ là một phần cấu thành phân tử protein hoặc là thành phần phân huỷ protein như là các peptid, axit amin, urê. Hàm lượng amoniac (NH3) chính là lượng nitơ amôn (NH4+) trong nước thải sinh hoạt, nước thải công nghiệp thực phẩm và một số loại nước thải khác có thể rất cao. Trong nước thải, các hợp chất của nitơ tồn tại dưới 3 dạng: các hợp chất hữu cơ, amoni và các hợp chất dạng ôxy hoá (nitrit và nitrat). Nitơ được chia làm hai nhóm vô cơ và hữu cơ. Nitơ vô cơ đa số là amoni, nitrat, nitrit hoặc ure. Nitơ hữu cơ thì phức tạp hơn, có thể là các amin bậc thấp, axit amin, protein.
Đánh giá chỉ tiêu Nitơ tức là đánh giá mức độ có mặt của các hợp chất Nitơ mà ta có thể biết được mức độ ô nhiễm nguồn nước. Các chỉ tiêu cơ bản để đánh giá hàm lượng Nitơ trong nước thải: N-NH4+, NH4+ ,NO -,NO2-, TKN( Tổng đạm) và TN( Nồng độ tổng đạm). Trong đó có sự khác biệt giữa ký hiệu N-NH4+ là lượng Nitơ trong amoni, còn NH4+ là lượng amoni. Chỉ số TKN hay còn gọi là tổng Nitơ Kendal sẽ xác định lượng Nitơ hữu cơ + lượng Nitơ ure + lượng Nitơ amoni. Nguyên lý cơ bản là chuyển hóa tất cả lượng Nitơ này thành NH3 rồi xác định lượng NH3.
Phương pháp để xác định Nitơ được quy định trong TCVN 6638:2000 do Ban kỹ thuật Tiêu chuẩn TCVN/147 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành. Tiêu chuẩn này quy định phương pháp xác định Nitơ trong các mẫu nước dưới dạng các hợp chất amoni, nitrit, nitrat và Nitơ hữu cơ có khả năng chuyển thành amoni trong những điều kiện của phương pháp. Hàm lượng Nitơ, PN tới 200 mg/l có thể xác định được.
Trong quá trình xác định Nitơ có một số cản trở khi quá trình vô cơ hóa quá lâu, một số hợp chất Nitơ hữu cơ rất khó vô cơ hóa. Tiêu chuẩn cũng đưa ra cảnh báo khi xác định Nitơ” Trong quá trình vô cơ hóa có thể sinh ra khí độc SO2, H2s hoặc HCn giải phóng từ mẫu bị ô nhiễm, do đó việc vô cơ hóa cần thực hiện trong tủ hút tốt. Thực hiện xác định Nitơ theo nguyên tắc dùng hợp kim Devarda khử các hợp chất Nitơ về amoni, Sau khi làm bay hơi đến gần khô thì chuyển Nitơ thành amoni Sunfat có mặt axit Sunfuric đậm đặc chứa Kali Sunfat ở nồng độ cao để làm tăng nhiệt độ sôi của hỗn hợp, đồng thời có mặt đồng để làm xúc tác. Giải phóng amoniac khỏi hỗn hợp bằng cách thêm kiềm và cất vào dung dịch Axit Boric/ chỉ thị. Xác định định lượng amoni trong phần cất ra bằng cách chuẩn độ với axit hoặc đo phổ ở bước sóng 655nm. Lưu ý mẫu cần chứa không quá 200mg Nitơ/l, nếu hàm lượng Nitơ cao hơn thì phải pha loãng bang nước trước khi hút 50ml mẫu thử.
Phương pháp xác định Nitơ như sau:
- Dùng pipet hút 50ml mẫu vào bình Kjeldahl. Thêm tiếp 4ml ± 0,1ml axit Sunfuric, 0,2g ± 0,01g hợp kim Devarda và 2,00g ± 0,05g Kali Sunfat.
- Sau ít nhất 60 phút, thêm vài hạt đá bọt và đun sôi lượng trong bình dưới tủ hút. Thể tích lượng trong bình giảm dần do nước bay đi.
- Khi khói trắng bắt đầu xuất hiện thì đậy phễu nhỏ vào cổ bình Kjeldahl để giảm sự bay hơi. Không đun đến cạn khô. Nhiệt độ của chất lỏng trong giai đoạn này không vượt quá 3700C.
- Sau khi hết bốc khói thì quan sát định kỳ sự vô cơ hóa, sau khi chất lỏng trở thành không màu hoặc xanh nhẹ, tiếp tục đun 60 phút ± 5 phút nữa.
- Để bình nguội đến nhiệt độ phòng. Trong khi đó lấy 20ml ± 2ml dung dịch axit Boric/ chỉ thị vào bình hứng của máy chưng cất. Đảm bảo rằng đầu mút của sinh hàn nhúng sâu vào dung dịch chỉ thị.
- Thêm cẩn thận 10ml ± 1ml nước vào bình đã vô cơ hóa, sau đó thêm 25ml dung dịch NaOH và lập tức nối bình vào máy chưng cất.
- Đun bình sao cho tốc độ cất khoảng 5ml/phút. Dừng cất khi đã thu được khoảng 30ml. Chuẩn độ phần cất được bằng HCl 0,02mol/l đến màu đỏ của chỉ thị đã có trong bình hứng, ghi thể tích tiêu tốn Nitơ trong nước thải cao, chảy vào sông, hồ làm tăng hàm lượng chất dinh dưỡng. Do vậy nó gây ra sự phát triển mạnh mẽ của các loại thực vật phù du như rêu, tảo gây tình trạng thiếu oxy trong nước, phá vỡ chuỗi thức ăn, giảm chất lượng nước, phá hoại môi trường trong sạch của thủy vực, sản sinh nhiều chất độc trong nước như NH4+ ,H2S , CO2, CH4… tiêu diệt nhiều loại sinh vật có ích trong nước. Hiện tượng đó gọi là phú dưỡng nguồn nước. Mặt khác, nitơ trong nước thải sẽ kết hợp với một số hóa chất trong xử.
Chúng tạo ra sản phẩm phụ gây hại cho quá trình vận hành xử lý. Do đó việc xác định Nitơ trong nước thải để giảm chất dinh dưỡng trong nước thải, giảm thiểu sự phú dưỡng hóa.
Chỉ tiêu phốt pho
Phospho tồn tại trong môi trường chủ yếu dưới dạng octophotphat (PO43-) có hóa trị 5+. Ở dạng này dễ được các thực vật ở cạn và ở nước hấp thụ. Động vật bài tiết lượng phospho trong thức ăn ở dạng phosphat qua nước tiểu. Photpho là chất dinh dưỡng cho vi khuẩn sống và phát triển trong các công trình xử lý nước thải, tồn tại chủ yếu ở dạng PO43- . Photpho theo dòng nước thải sinh hoạt, sản xuất và hoạt động nông nghiệp chưa qua xử lý xả xuống các thủy vực là nguyên nhân gây ô nhiễm nguồn nước. Sự dư thừa photpho là một vấn đề đối với môi trường.
Photpho tồn tại ở các dạng hợp chất khác nhau trong nước ngầm, nước mặt và nước thải với các nồng độ khác nhau, ở dạng hòa tan và không tan, vì vậy cần một tiêu chuẩn riêng để hướng dẫn phương pháp xác định photpho. TCVN 6202:2008 Chất lượng nước – Xác định Phospho – Phương pháp đo phổ dùng Amoni Molipdat do Ban kỹ thuật tiêu chuẩn TCVN/TC 147 Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Tiêu chuẩn này quy định các phương pháp xác định: Octophosphat (Điều 4); Phosphat sau khi chiết với dung môi (Điều 5); Phosphat có thể thủy phân được và octophosphat (Điều 6); tổng Phosphat sau khi phân hủy (Điều 7 và 8).
Nồng độ photpho cao làm quá trình tảo phát trìển mạnh, gây nên hiện tượng phú dưỡng. Khi tảo chết đi, quá trình phân hủy kị khí diễn ra làm giảm lượng oxy hòa tan trong nước, làm giảm chất lượng nước, gây nguy hiểm cho cá, các loài thủy sinh và con người. Trong thiên nhiên, photpho là sản phẩm của quá trình lân hóa, thường gặp ở dạng vết. Khi hàm lượng photpho cao là yếu tố giúp rong rêu, tảo phát triển. Đây có thể là nguồn gốc do ô nhiễm nước thải sinh hoạt, nông nghiệp, công nghiệp sản xuất bột giặt, chất tẩy rửa, phân bón. Do đó chỉ tiêu photpho được ứng dụng trong việc kiểm soát ô nhiễm của dòng nước. Việc xác định photpho rất cần thiết không chỉ đáp ứng yêu cầu quan trắc giới hạn xả thải mà còn để đánh giá hiệu suất và chi phí xử lý của quá trình loại trừ photpho. Xác định photpho còn có vai trò trong vận hành các trạm xử lý nước thải và trong nghiên cứu ô nhiễm của nhiều vùng vì hàm lượng photpho có thể coi là chất dinh dưỡng cho VSV phát triển trong xử lý nước thải.
Chỉ tiêu độ đục
Độ đục được sử dụng đối với nước có chứa các chất lơ lửng làm ảnh hưởng đến khả năng tán xạ hoặc sự hấp thụ ánh sáng qua nước hoặc hạn chế khả năng quan sát. Các chất lơ lửng, hạt keo (kích thước khoảng 0,001µm đến 1µm), hạt phân tán mịn (kích thước lớn hơn 0,001m, kích thước phân tử), hạt phân tán thô (kích thước lớn hơn 1µm) hoặc huyền phù cũng đều gây ra độ đục tùy theo mức độ xáo trộn của chúng trong nước. Độ đục thường được sử dụng như là một chỉ số về chất lượng nước, nó dựa vào sự trong suốt của nước và tổng số ước tính chất rắn lơ lửng trong nước.
Độ đục của nguồn nước thường do các hoạt động canh tác nông nghiệp và các hoạt động khai thác khác (phá rừng, xây đập thủy điện, ..) làm xáo trộn dòng chảy, xói mòn làm cho một lượng lớn đất bề mặt bị rửa trôi. Lượng đất bị rửa trôi này có thành phần chủ yếu là các chất vô cơ, đất sét, phù sa và các chất hữu cơ. Nước thải sinh hoạt và một số nước thải công nghiệp có chứa một lượng đáng kể các chất hữu cơ và một phần các chất vô cơ có khả năng gây ra và làm tăng độ đục của các nguồn nước. Các chất hữu cơ và vô cơ trong nước rửa đường phố cũng gây ra một phần độ đục. Các chất hữu cơ trong nước sông là nguồn thức ăn cho vi sinh khuẩn. Vi khuẩn phát triển trở thành thức ăn cho các nhóm vi sinh vật khác. Các vi sinh vật này cũng tạo ra độ đục của nước. Các chất dinh dưỡng vô cơ như nitơ và photpho tồn tại trong nước thải, nước chảy tràn từ hoạt động nông nghiệp sẽ thúc đẩy tảo phát triển và cũng góp phần gây ra độ đục của nước.
Phương pháp chuẩn để đo độ đục phụ thuộc vào thiết bị sử dụng nguyên lý quá trình truyền ánh sáng. Trong thiết bị này, một nguồn sáng chiếu qua mẫu và một hoặc nhiều đầu dò quang điện được sử dụng nối với thiết bị đọc để xác định cường độ của dòng ánh sáng ở góc chiếu phù hợp đến đường truyền của dòng ánh sáng tới. Cũng có thể lắp đặt thiết bị đo tự động để có thể đo liên tục độ đục của nước khi cần kiểm soát quá trình hoặc giám sát chất lượng nước.
Việc kiểm tra độ đục trong nước khá quan trọng, khi độ đục vượt quá mức cho phép sẽ gây ảnh hưởng đến sức khỏe con người khi sử dụng nguồn nước. Độ đục còn liên quan đến hiệu quả xử lý của nhà mày xử lý nước cấp, rò rỉ đường ống, hoặc ô nhiễm từ nước thải. Việc lọc nước trở nên khó hơn và chi phí vận hành cao hơn khi độ đục của nước tăng. Việc sử dụng bể lọc chậm không khả thi khi độ đục cao vì làm giảm chu kỳ lọc và tăng chi phí rửa lọc. Việc vận hành hợp lý bể lọc nhanh thường phụ thuộc vào hiệu quả khử độ đục bằng quá trình keo tụ tạo bông và lắng trước khi dẫn vào bể lọc. Độ đục làm giảm khả năng tự làm sạch của nước, giảm khả năng sản xuất của ao hồ bị giảm cường độ quanh hợp của thực vật phù du khiến các loài thủy sản có thể bị nghẹt bộ phận hô hấp, thiếu thức ăn. Theo các tiêu chuẩn nước sạch quy định độ đục nhỏ hơn 5NTU, tuy nhiên giới hạn của nước uống là 2NTU.
Chỉ tiêu độ màu
Nước mặt trong tự nhiên có độ màu do các hạt cận lơ lung có màu, mùn sắt (II), lignin, sông ở vùng đất đỏ, các sản phẩm từ sự phân hủy các chất hữu cơ…tạo ra. Ngoài ra, một số ion kim loại có màu, các hợp chất màu của các nhà máy dệt nhuộm hay nước thải của các nhà mày chế biến cũng là nguyên nhân gây cho nước có màu. Trong nước sinh hoạt các chất tẩy rửa, dầu mỡ, các chất hữu cơ bị phân hủy cũng gây nên độ màu. Độ màu do các cặn lơ lửng gây ra được gọi là độ màu biểu kiến và độ màu do các chất hòa tan dưới dạng keo hình thành từ quá trình phân hủy thực vật và chất hữu cơ gây ra được gọi là độ màu thực. Trong phân tích nước, điều quan trọng là phải phân biệt được độ màu thực và độ màu biểu kiến. Cường độ màu thường tăng khi pH tăng, nên cần phải đo pH khi đo độ màu.
Có thể xác định độ màu bằng 2 phương pháp:
- Xác định độ màu bằng thiết bị quang học: dựa trên sự hấp thu ánh sáng của các hợp chất màu có trong dung dịch.
- Xác định độ màu bằng mắt thường: mẫu biểu kiến và mẫu thực.
Mẫu biểu kiến: lấy 50ml mẫu cho vào ống Nessler, rồi đặt lên giá so màu bằng cách đặt ống chen giữa từng cặp ống màu chuẩn theo thứ tự tăng dấn. Nền trắng dưới đáy so màu phải quay về phía ánh sáng, người quan sát đứng phía sau và nhìn qua miệng ống xuyên suốt cột nước. Di chuyển dần ống mẫu cho đến khi độ màu giữa hay gần trùng cặp ống chuẩn nào thì dừng lại và ghi nhận kết quả. Lập lại một lần nữa theo chiều ngược lại từ phía màu sậm đến nhạt dần, so sánh hai kết quả thu nhận được. Nếu màu mẫu nước đậm hơn dãy chuẩn thì ta pha loãng mẫu và tiến hành phép so sánh lại như trên.
Mẫu thực: quay li tâm cho đến khi loại bỏ hoàn toàn các huyền phù, không có quy định nào cho thời gian và tốc độ li tâm, nó phụ thực vào đặc tính và hàm lượng các chất huyền phù có trong mẫu. nhưng thường không quá 1 giờ. Bước này có thể thay thế bằng cách lọc mẫu qua màng lọc 0,45 µm. Sau đó tiến hành xác định tương tự như xác định mẫu biểu kiến.
Độ màu sẽ được xác định bằng công thức:
Độ màu (đơn vị Pt-Co) = (C x 50) / A
Với C là độ màu được ghi từ màu pha loãng, A là thể tích mẫu nguyên thủy dùng để pha loãng (ml)
Màu của nước thải mới có màu nâu hơi sáng, tuy nhiên thường có màu xám vẩn đục. Màu sắc của nước thải sẽ thay đổi đáng kể nếu như bị nhiễm khuẩn, khi đó sẽ có màu đen tối. Màu được xác định bằng phương pháp so màu với các dung dịch chuẩn Pt-Co.
Độ màu của nước là một trong hai yếu tố quyết định công nghệ xử lý và liều lượng phèn sử dụng. Đối với nước cấp độ đô thị có đảm bảo giá trị cảm quan, độ sạch của nước hay không. Đối với nước thải độ màu đánh giá phần nào mức độ ô nhiễm nguồn nước. Các nguồn nước sử dụng cho con người phải có độ màu nhở hơn 15 đơn vi độ đo mẫu thực, độ màu tối đa không vượt quá 15 TCU.
Chỉ tiêu độ pH
pH là chỉ số xác định tính chất hóa học của nước, được sử dụng rộng rãi để biểu diễn mức độ axit hoặc kiền trong dung dịch, cách biểu diễn nồng độ của ion hidro, chính xác hơn là hoạt tính của ion hidro. Thang pH chỉ từ 0-14 về lý thuyết, nước có pH = 7 là trung tính. Nước thải sinh hoạt có pH = 7,2-7,6. Nước thải công nghiệp có pH rất khác nhau phụ thuộc từng loại công nghiệp
Đo pH bằng phương pháp so màu: giấy quỳ (đỏ-xanh),bảng màu, dung dịch chỉ thị màu. Đo pH bằng máy: chuẩn bộ máy bằng dung dịch chuẩn (pH 4, 7, 10), nhúng điện cực vào mẫu cần đo, rửa điện cực bằng nước cất mỗi khi xong phép đo.
pH có vai trò quan trọng trong hầu hết các quá trình của lĩnh vực kỹ thuật công nghệ môi trường. Trong nước pH là yếu tố quan trọng ảnh hưởng đến qua trình keo tụ hóa học, oxy hóa, khử trùng, làm mền và kiểm soát tính ăn mòn của nước. Trong xử lý nước thải bằng các quá trình sinh học làm việc tốt khi pH nằm trong giới hạn từ 7-7,6. pH phải được duy trì trong giới hạn tối ưu cho sự phát triển của vi sinh vật. Đồng thời pH còn được sử dụng để đánh giá các giai đoạn đang xãy ra trong qua trình xử lý. Các quá trình hóa học sử dụng để keo tụ nước thải, tách nước khỏi bùn hoặc oxy hóa một số hợp chất như hợp chất chứa xyanua, thường đòi hỏi pH phải được duy trì trong một giơi hạn hep. Ngoài ra pH còn ảnh hưởng đến quá trình tạo bông cặn của các bể lắng bằng cách tạo bông cặn bằng phèn nhôm. Theo tiêu chuẩn, pH của nước sử dụng cho sinh hoạt là 6,0–8,5 và của nước uống là 6, –8,5.
Chỉ tiêu độ mùi
Mùi vị của nước phụ thuộc vào sự cảm quan của mỗi người, moioc khi bị kích thích bỏi các hợp chất hóa học trong tự nhiên. Trong nước thải, mùi xuất hiện do các khí sinh ra trong quá trình phân hủy các hợp chất hữu cơ hay do một số chất được đưa thêm vào.Hợp chất gây mùi đặc trưng nhất là H2S mùi trứng thôi. Các hợp chất khác, chẳng hạn như indol, skatol, cadaverin và cercaptan được tạo thành dưới điều kiện yếm khí có thể gây ra những mùi khó chịu hơn cả H2S.
Một số chất có mùi được nêu trong bảng
| Chất có mùi | Công thức hóa học |
Mùi |
|
Amoni |
NH3 |
Khai |
|
Phân |
C8H5NHCH3 |
Phân |
|
Hydrosunfua |
H2S |
Trứng thối |
| Sunfua hữu cơ |
(CH3)2S, CH3S-SCH3 |
Bắp cải rửa |
|
Mercaptan |
CH3SH, CH3(CN2)3SH |
Hôi |
|
Amin |
CH3NH2, (CH3)2N |
Cá ươn |
|
Diamin |
NH2(CH2)4NH |
Thịt thối |
|
Clo |
Cl2 |
Nồng |
|
Phenol |
C6H5-OH |
Xốc đặc trưng |
Việc xác định mùi theo tiêu chuẩn tương đối phức tạp. Để đánh giá sơ bộ về mùi có thể dùng một phương pháp đơn giản như phương pháp cảm quan để xác định đặc tính và cường độ mùi. Lấy 100ml mẫu nước cần thử ở nhiệt độ 20OC vào bình đến phân nửa thể tích đậy nắp, lắc 10-20 giây. Mở nắp và ngửi mùi, ghi chép độ mùi theo các mức: không mùi, mùi rất nhẹ, mùi nhẹ, mùi trung bình, mùi nặng, mùi rất nặng. Để xác định mẫu ở nhiệt độ 60OC thì cũng thực hiện lấy mẫu nước như trên rồi đây nắp lại và đun cách thủy đến 60OC, lắc mở nắp và ngửi lại.
Nguồn nước sạch là nguồn nước không mùi không vị, khi nước có mùi là dấu hiệu nước đã bị ô nhiễm. Mùi vị có thể được sử dụng để đánh giá mực độ ô nhiễm,sự độc hại của nước, và một phần có thể xác định được nguồn gốc phát sinh của nước thải. Mùi nước thải rất đa dạng, tùy vào hoạt động sản xuất hay sinh hoạt mà nước thải có mùi đặc trưng riêng. Mùi là yếu tố đề đánh giá chất lượng nước uống, chất lượng thực phẩm và mỹ quan.
Chỉ tiêu nhiệt độ
Nhiệt độ của nước tự nhiên phụ thuộc vào điều kiện khí hậu thời tiết hay môi trường của khu vực. Nhiệt độ nước thải công nghiệp thường cao hơn từ 10-25C so với nước thường do việc xả thải các dòng nước nóng hoặc ấm từ các hoạt động sinh hoạt, thương mại hay công nghiệp sản xuất.
Nhiệt độ được xác định bằng cách đo trực tiếp ngay tại nơi lấy mẫu bằng nhiệt kế. Cách lấy mẫu theo TCVN 4556:1988, mẫu lấy để xác định nhiệt độ không lấy riêng mà đo ngay vào chai lấy mẫu để xác định chung các chất. Nước lấy vào chai lấy mẫu, lắc đều, nhúng bầu thuỷ ngân của nhiệt kế vào nước và giữ yên ở đó 5 phút, ngay sau đó đọc nhiệt độ, tránh để bầu thuỷ ngân áp vào thành chai. Khi đo nhiệt độ của nguồn nước sâu không quá 5m, buộc nhiệt kế vào dây và thả ngập vào nguồn nước cần xác định nhiệt độ. Giữ yên 15 phút và kéo nhiệt kế lên xác định nhiệt độ. Khi đo nhiệt độ ở nguồn nước sâu hơn 5m, phải dùng nhiệt kế đặc biệt có khả năng giữ nguyên nhiệt độ khi đã kéo ra khỏi nguồn nước cần xác định nhiệt độ. Buộc nhiệt kế vào dây thả ở chiều sâu cần thiết và để yên 15 phút, kéo lên đọc nhiệt độ. Dụng cụ để đo là nhiệt kế bách phân từ 0-1000C.
Nhiệt độ của nước thải là một trong những thông số quan trọng để xử lý nước thải. Bởi vì phần lớn các sơ đồ công nghệ xử lý nước thải đều ứng dụng các quá trình xử lý sinh học mà các quá trình đó thường bị ảnh hưởng mạnh bởi nhiệt độ. Nhiệt độ của nước thải ảnh hưởng đến đời sống của thủy sinh vật, đến sự hòa tan oxy trong nước. Nhiệt độ còn là một trong những thông số công nghệ quan trọng liên quan đến quá trình lắng các hạt cặn.
Chỉ tiêu độ dẫn điện
Độ dẫn điện của nước (Electrical Conductivity : EC) là một chỉ số về chất lượng nước, có thể xác định nông độ của dung dịch, xác định chất gây ô nhiễm và xác định độ tinh khiết của nước. Đo độ dẫn điện là đo khả năng dẫn điện của nước. Muối hoặc các hóa chất khác hòa tan trong nước có thể phân hủy thành các ion tích điện dương và tích điện âm. Những ion tự do này trong nước có thể dẫn điện, do đó độ dẫn điện của nước phụ thuộc vào nồng độ của các ion. Các ion tích điện dương lớn ảnh hưởng đến độ dẫn của nước là natri, canxi, kali và magie. Các ion tích điện âm lớn là clorua, sunfat, cacbonat và bicarbonate. Nitrat và phốt phát là những chất có thể dẫn điện, nhưng chúng lại rất quan trọng về mặt sinh học. Ngoài ra, đo độ dẫn điện cũng nhằm để xác định phần nào ion kim loại có trong nước.
Độ dẫn điện của nước phụ thuộc vào tỷ lệ thuật với nhiệt độ của nước. nhiệt độ của nước tăng lên 10C thì đô dẫn điện của nước sẽ tăng 2-3%. Thông thường độ dẫn điện được đo ở nhiệt độ tiêu chuẩn là 25C. Độ mặn và tổng chất rắn hòa tan (TDS) được sử dụng để tính EC của nước, giúp chỉ ra độ tinh khiết của nước. Nước tinh khiết càng thấp thì độ dẫn điện càng thấp. Để đưa ra một ví dụ thực tế, nước cất gần như là chất cách điện, nhưng nước mặn lại là một chất dẫn điện rất hiệu quả.
Để xác định độ dẫn điện, người ta thường dùng máy đo điện trở, cường độ dòng điện hoặc bút đo độ dẫn điện. Máy đo độ dẫn điện của nước EC là một loại máy kỹ thuật số rất nhỏ gọn rất tiện dụng, phạm vi đo lường rộng, tự động cân bằng nhiệt độ, pin lâu, màn hình LCD lớn, không thấm nước, với chức năng giữ dữ liệu và cảnh báo điện áp thấp. Trong số đó, máy đo độ dẫn điện của nước CD-138(II) là một loại máy được sử dụng rộng rãi.
Chỉ tiêu độ mặn
Độ mặn là thước đo nồng độ muối hòa tan trong nước. Độ mặn được đo gián tiếp bằng cách kiểm tra độ dẫn điện (EC) của nước. Nước mặn dẫn điện nhiều hơn nước không có muối hòa tan. Nước ngọt hầu như không có muối hòa tan, trong khi nước biển có độ mặn trong khoảng 34-36ppt. Nước lợ là hỗn hợp của nước ngọt và nước mặn. Độ mặn của nước là một thước đo quan trọng về chất lượng nước bởi vì các loài động thực vật khác nhau sẽ tồn tại trong môi trường nước có độ mặn khác nhau. Ngay cả khi có sự thay đổi nhỏ về độ mặn, có thể ảnh hưởng đến khả năng sinh trưởng và gây chết cho các vi sinh vật. nước thải có độ mặn cao gồm có nước thải sinh hoạt, nước thải chân nuôi thủy hải sản, nước mưa, nước thải công nghiệp chế biến.
| Trạng thái của nước | Độ mặn (ppt) |
| Nước ngọt |
<0,5 |
| Nước lợ |
0,5-30 |
| Nước mặn |
30-50 |
| Nước muối |
>50 |
Xác định độ mặn bằng hai phương pháp sau: xác định bằng bút đo độ mặn. Bút bỏ
túi LAQUAtwin Salt 11 xác định độ dẫn của mẫu đo sau đó chuyển thành giá trị độ mặn dựa trên đường chuẩn độ mặn được lựa chọn. Cảm biến với hai đầu kim loại titan phủ bạch kim đen chống ăn mòn và cảm biến nhiệt độ để thực hiện phép đo chính xác. Bút đo được lập trình với hai đường chuẩn -nước biển và natri clorua (NaCl).
Độ mặn là một yếu tố quan trọng trong việc xác định nhiều khía cạnh hóa học của nước tự nhiên và các quá trình sinh học do ảnh hưởng đến nồng độ ôxy hòa tan trong nước. Khả năng hòa tan của oxy trong nước giảm khi độ mặn tăng lên. Khả năng hòa tan của oxy trong nước biển ít hơn khoảng 20% so với nước ngọt khi ở cùng nhiệt độ. Sinh vật nước mặn tồn tại ở độ mặn lên tới 40 ppt, tuy nhiên nhiều sinh vật nước ngọt không thể sống khi độ mặn vượt quá 1 ppt.











